首页 >
公司动态
>
人CD3+T淋巴细胞阳性分选原理...
人CD3+T淋巴细胞阳性分选原理及注意事项
2022-06-22
一、细胞分选方法概述
细胞学研究中一个很重要的课题就是细胞的分离纯化,尤其是需要对某种特定的细胞进行功能研究,如对细胞培养上清液通过ELISA分析检测细胞因子、细胞共培养检测细胞功能等,都需要得到高纯度的目的细胞。因此,高效地分离所需要的目的细胞是进行细胞功能研究的先决条件。
细胞分选(cell sorting)是指根据细胞所具有的特性把某种特定的细胞亚群从混合的细胞样品中分离出来的一种技术,它是对某一特定细胞进行生化分析和功能分析的前提和基础。常用的细胞分选方法主要有两大类:一类是基于细胞物理性质的密度梯度离心法(Density gradient centrifugation),另一类是基于免疫识别特性的方法,包括荧光激活细胞分选方法(Fluorescence-activated cell sorting,FACS)和磁性激活细胞分选法(Magnetic-activated cell separation,MACS)。
密度梯度离心法是基于不同的细胞群之间存在沉降系数差异的原理建立起来的,在一定的离心力的作用下,不同种类的细胞会以各自不同的速度沉降,在密度梯度不同的区域上会形成区带。这种方法简单易行,但此种方法分离所得到的细胞纯度较低,且细胞表面的标志不明确,特异性较差,目前使用较少。
流式细胞术(Flow Cytometry,FCM)是20世纪60年代后期发展起来的一种利用流式细胞仪(Flow cytometer)进行快速定量分析细胞亚群的物理化学特性,根据这些物理化学特性精确分选细胞的新技术,FCM主要包括流式分析和流式分选两部分。FACS最初于1972年提出,是指荧光驱动的细胞分选新技术,即利用分选型流式细胞仪分选标记有荧光素偶联抗体的细胞样品,通过荧光系统区分目的细胞和非目的细胞。流式细胞仪通过接受激光照射后液流内细胞的散射光信号和荧光信号反映细胞的物理化学特性,如细胞的大小、颗粒度以及抗原分子的表达情况等,目前已被广泛应用于生命科学及其相关领域的基础研究。流式细胞分选被认为是细胞分选的“金标准”,它分选所得的细胞纯度高、回收率高、且操作环境为全封闭型,不易被污染。但是,该方法所需设备比较昂贵,耗时,且需要高水平的技术支持以及专业的操作人员;且该方法在一段时间内只能分选一个细胞样品,若试验需要从不同的样品中分选目的细胞时这种方法不可行;同时,由于FACS对细胞刺激较大,因此对分选出的细胞活性有较大影响。
磁性细胞分选(MACS)是20世纪70年代发展起来的,是用结合有抗体的免疫磁珠与样品细胞进行孵育,表达有相应抗原的细胞就会特异性的结合在包被有抗体的免疫磁性微粒上,当体系缓慢的经过磁场时,带有磁珠的细胞就会滞留在磁铁上,而非目的细胞由于未结合磁珠仍存在与混合细胞悬液中,从而达到分离纯化细胞的目的。MACS法是一种相对高效简便的细胞分选方法,所需设备简单,只需一块专用磁铁即可进行分选,操作较为简单,对操作人员的技术要求也不高,一般实验室都可进行磁性分选。磁性分选只是让细胞处于一个低磁场中,基本可以忽略对细胞的影响,分离得到的细胞具有较高的复苏率及细胞活性,对于下游应用影响较小,在保持细胞活性方面优于流式分选。磁性分选因其高灵敏度、高纯度、易操作、对目的细胞刺激较小等特性成为了细胞分选的首选方法,具有潜在的应用前景。
二、免疫磁性细胞分选
2.1 原理
磁性细胞分选是基于免疫学中抗原抗体之间特异性结合的原理进行的。以磁性微粒作为载体,对其进行抗体或亲和配体包被,形成免疫磁性复合微粒,当其与混合细胞孵育后,磁性微粒表面抗体会与细胞表面的抗原决定簇发生抗原抗体的特异性反应,使得细胞被磁性复合微粒标记。在外加磁场的作用下,抗体与磁珠相连的细胞会因磁珠的磁性而滞留在磁场中,而不表达此抗原的细胞因不能与磁珠表面的特异性抗体结合而没有磁性,不能够在磁场中滞留,从而使目的细胞与非目的细胞分开,得到较高纯度的目的细胞。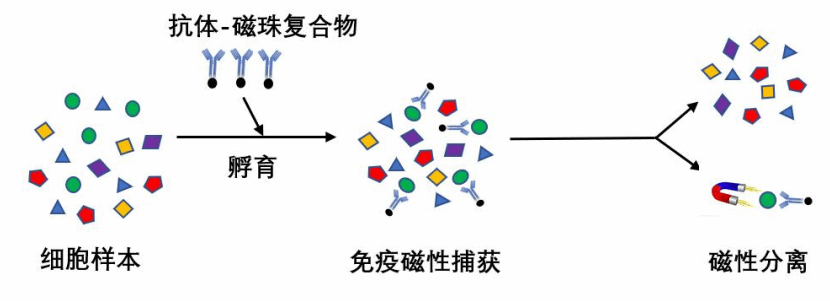
图1 免疫磁性细胞分选原理示意图
2.2 免疫磁性细胞分选系统的分类
根据不同的分类标准,可以将免疫磁性细胞分选系统分为不同种类。
2.2.1 依据所标记细胞的不同分类
根据分选过程中所标记细胞类型的不同将免疫磁性细胞分选系统分为阳性分选、阴性分选和复合分选。
阳性分选(IPHASE人CD3+T细胞阳性分选试剂盒),即将目的细胞亚群直接从细胞悬液中分离出来。通过磁珠包被目的细胞的特异性抗体与混合细胞悬液孵育,在抗原抗体发生特异性结合后,通过磁分离方式,将目的细胞分离出来。
阴性分选,即从多细胞悬液中分离去除非目的细胞而得到目的细胞的一种方法。此方法的优点在于整个分选过程中目的细胞都未与磁珠(IPHASE SA磁珠)结合。由于抗原抗体的结合可能会引起细胞膜表面的信号传递,因此,此法具有较大的优势。但同时此方法也有不足之处,当靶细胞的细胞数所占细胞比例较小时,分选过程中存在的非特异性吸附会直接导致目的细胞的损失,此外,非目的细胞未被充分去除等,都会使得细胞的分选效率和分选纯度较低。
复合分选是指联合使用两种以上的分选策略进行分选,这种方法主要用于细胞亚群的分选或者想要分离得到高纯度的稀有细胞。
2.2.2 依据分选方法的不同分类
根据分选方法的不同可以将免疫磁性细胞分选分为直接分选法和间接分选法。
直接分选法是指将抗体或者亲和配体直接包被在磁性颗粒上,形成免疫磁性复合微粒,将其与多细胞悬液混合孵育之后,目的细胞会特异性的结合在免疫磁珠上,在外加磁场作用下,带有磁珠的目的细胞会滞留在磁场中,而非目的细胞则会被去除。
间接分选法分选细胞引入了二抗,即将目的细胞首先与对应的一抗孵育,激活细胞,之后清洗出去未结合的一抗,然后加入预先包被有二抗的磁性颗粒与活化后的细胞孵育,一抗与二抗之间的相互作用会导致磁粒结合在目的细胞上,同样在磁场作用下滞留目的细胞,达到分选的目的。
2.3 免疫磁性细胞分选系统的组成
免疫磁性细胞分选系统主要有磁性微粒、待标记抗体、磁性分离器(磁力架)、缓冲体系等组成。其中,磁性微粒的选择是分选成败的关键。
磁性微粒是指具有磁性或超顺磁性的粒子、磁性胶质体、磁性脂质体等。较为常见的磁性物质为Fe3O4或γ-Fe2O3磁性微粒;也有二氧化铬和铁素体的磁性微粒。应用于细胞分选的磁粒(IPHASE SA磁珠)具有非常严格的标准,其化学性质必须稳定,分散性好,在细胞悬液中不团聚,去掉外加磁场后没有磁滞现象,且不能吸附非特异性细胞,磁粒储存过程中亲和配体不能掉落,分选过程中可迅速、完全的被磁性分离,并可最大限度地减少细胞的吞噬作用。
磁性微粒的粒径大小对于细胞分选具有很关键的作用,因为粒径直接决定了磁粒的物理性质与可操作性。粒径较大的磁粒(>1μm)和粒径较小的磁粒(50~200nm)在细胞分选中都有广泛的应用。在某些情况下,不同的实验要求需要使用不同特性的磁粒。磁粒粒径的大小与其标记细胞的能力有很大关系,粒径大的磁粒可以负载更多的标记细胞接受部位。并且,细胞分选过程中,标记了较大磁粒的细胞,更容易被磁性分离器吸附,对磁性分离器的要求较低,简单、便宜、磁场强度较低的的磁分离器就可以满足要求。标记物或小分子标记物标记的粒径小的磁粒,却需要昂贵高强度的磁性分离器才能成功分选靶细胞。
2.4 免疫磁性细胞分选的过程
磁性细胞分选过程分为磁性标记及磁性分离两个过程。从复杂样品中分选靶细胞的流程大致分为三个步骤:
第一步,磁性标记物与含有靶细胞的细胞悬液混合孵育。孵育过程中,靶细胞与标记物相互作用,通过磁性分离把磁性标记物-靶细胞偶联产物与其它细胞分离。
第二步,清洗磁性标记物-靶细胞复合物,去除杂质。在这个过程中,可直接将磁性复合物-靶细胞复合物用来进行细胞培养,也可以裂解细胞,通过色谱分析、电泳或等方法分析细胞内容物。
第三步,磁性标记物与靶细胞的分离、移除。将磁性标记物与靶细胞分开,通过磁性分离去除磁性标记物,释放靶细胞,以便后续实验的进行。
2.5 免疫磁性细胞分选应用
作为细胞生物学研究的前提和基础,细胞分选技术已经得到了广泛的应用。随着细胞分选技术的不断发展,免疫磁性细胞分选技术已越来越受到研究者的的认可,目前已有许多商业化的试剂盒和分选磁珠(IPHASE SA磁珠)应用于细胞亚群的分选。最常见的为从人的外周血中分离细胞亚群,如B淋巴细胞、T淋巴细胞、单核细胞、粒细胞、自然杀伤细胞等。
2.6 免疫磁性细胞分选效果的评价
细胞分选效果的评价指标主要包括分选纯度和分选得率。
分选纯度是指被分选出所有细胞中目的细胞所占的百分比。
分选得率是指被分选出来的细胞数与原混合细胞悬液中该种目的细胞数的百分比。
三、人CD3+T淋巴细胞免疫磁性细胞分选
3.1 CD3+T淋巴细胞概述
免疫细胞(immune cell)是白细胞的俗称,包括淋巴细胞和各种吞噬细胞等,也特指能识别抗原、产生特异性免疫应答的淋巴细胞等,淋巴细胞是免疫系统的基本成分。
淋巴细胞包括T淋巴细胞(CD3+)、B淋巴细胞(CD3-CD19+)、NK细胞(CD3-CD16+CD56+),其中T淋巴细胞是淋巴细胞的主要组成。
T淋巴细胞是胸腺依赖淋巴细胞(thymus dependent lymphocyte),简称T细胞。CD3+T淋巴细胞代表全T淋巴细胞,包括辅助/诱导T淋巴细胞(CD3+CD4+)、抑制/细胞毒T淋巴细胞(CD3+CD8+)、CD4+T细胞纯真亚群(CD4+CD45RA+/ CD4+CD45RA+62L+)和记忆亚群(CD4+CD45RA-/ CD4+CD45RO+)、功能亚群(CD28+)、激活亚群(CD38+、HLA-DR+)、凋亡亚群(CD95+)等。
3.2人CD3+T淋巴细胞分选试剂盒简介
IPHASE/汇智和源顺应市场需求,推出了可用于人CD3+T淋巴细胞分选的试剂盒,助力于生命科学的研究。根据分选样品的不同,分为适用于人PBMC样品分选和适用于人全血样品分选的两种试剂盒。试剂盒操作简单便捷,各成分对细胞无毒性,且可实现高纯度细胞分离的目的,为下游实验提供便捷。
3.3 试剂盒特点
? 便捷性 只需一步操作,即可实现高纯度细胞分选。
? 高效性 分选得到目的细胞最短只需15min。
? 高纯度 细胞分选纯度可达95%以上。
? 高活性 细胞分选后目的细胞存活率高。
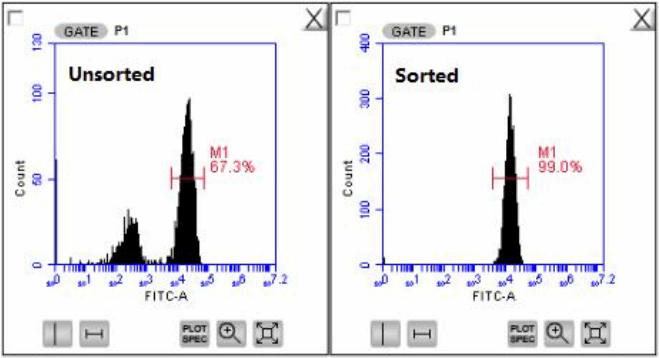
图1
图1为使用人CD3+T细胞阳性分选试剂盒分离人全血后,使用克隆号为HIT3a的人CD3-FITC流式抗体进行染色后,经流式细胞仪分析结果。左图为未经分选流式图;右图为经阳性分选后的流式图。
3.4试剂盒原理
采用免疫磁珠阳性分选的方法,利用偶联于磁性微粒上人CD3单克隆抗体的高度特异性,使磁珠特异性结合PBMC(人外周血单个核细胞或脐带血单个核细胞)中的CD3+ T细胞,通过外加磁场的作用,使得CD3+ T细胞得以滞留在磁场中而被分离出来。
4.3试剂盒组成
4.4 试剂盒分选流程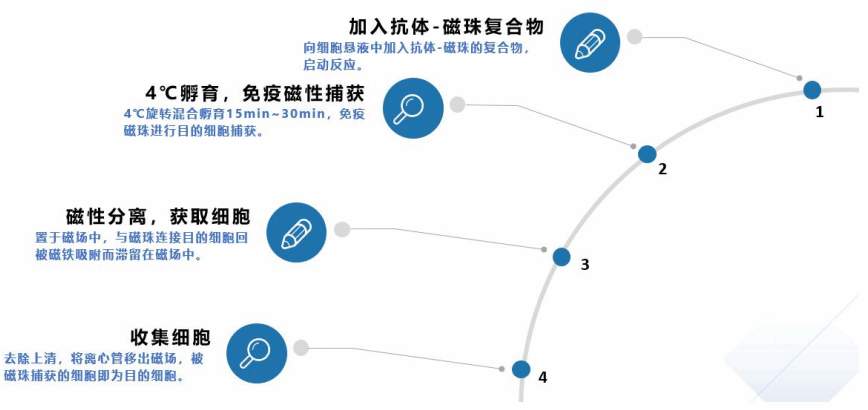
图2 试剂盒分选流程



