1 细胞分选方法概述
细胞学研究中一个很重要的课题就是细胞的分离纯化,尤其是需要对某种特定的细胞进行功能研究,如对细胞培养上清液通过ELISA分析检测细胞因子、细胞共培养检测细胞功能等,都需要得到高纯度的目的细胞。因此,高效地分离所需要的目的细胞是进行细胞功能研究的先决条件。
细胞分选(cell sorting)是指根据细胞所具有的特性把某种特定的细胞亚群从混合的细胞样品中分离出来的一种技术,它是对某一特定细胞进行生化分析和功能分析的前提和基础。常用的细胞分选方法主要有两大类:一类是基于细胞物理性质的密度梯度离心法(Density gradient centrifugation),另一类是基于免疫识别特性的方法,包括荧光激活细胞分选方法(Fluorescence-activated cell sorting,FACS)和磁性激活细胞分选法(Magnetic-activated cell separation,MACS)。
密度梯度离心法是基于不同的细胞群之间存在沉降系数差异的原理建立起来的,在一定的离心力的作用下,不同种类的细胞会以各自不同的速度沉降,在密度梯度不同的区域上会形成区带。这种方法简单易行,但此种方法分离所得到的细胞纯度较低,且细胞表面的标志不明确,特异性较差,目前使用较少。
流式细胞术(Flow Cytometry,FCM)是20世纪60年代后期发展起来的一种利用流式细胞仪(Flow cytometer)进行快速定量分析细胞亚群的物理化学特性,根据这些物理化学特性精确分选细胞的新技术,FCM主要包括流式分析和流式分选两部分。FACS最初于1972年提出,是指荧光驱动的细胞分选新技术,即利用分选型流式细胞仪分选标记有荧光素偶联抗体的细胞样品,通过荧光系统区分目的细胞和非目的细胞。流式细胞仪通过接受激光照射后液流内细胞的散射光信号和荧光信号反映细胞的物理化学特性,如细胞的大小、颗粒度以及抗原分子的表达情况等,目前已被广泛应用于生命科学及其相关领域的基础研究。流式细胞分选被认为是细胞分选的“金标准”,它分选所得的细胞纯度高、回收率高、且操作环境为全封闭型,不易被污染。但是,该方法所需设备比较昂贵,耗时,且需要高水平的技术支持以及专业的操作人员;且该方法在一段时间内只能分选一个细胞样品,若试验需要从不同的样品中分选目的细胞时这种方法不可行;同时,由于FACS对细胞刺激较大,因此对分选出的细胞活性有较大影响。
磁性细胞分选(MACS)是20世纪70年代发展起来的,是用结合有抗体的免疫磁珠与样品细胞进行孵育,表达有相应抗原的细胞就会特异性的结合在包被有抗体的免疫磁性微粒上,当体系缓慢的经过磁场时,带有磁珠的细胞就会滞留在磁铁上,而非目的细胞由于未结合磁珠仍存在与混合细胞悬液中,从而达到分离纯化细胞的目的。MACS法是一种相对高效简便的细胞分选方法,所需设备简单,只需一块专用磁铁即可进行分选,操作较为简单,对操作人员的技术要求也不高,一般实验室都可进行磁性分选。磁性分选只是让细胞处于一个低磁场中,基本可以忽略对细胞的影响,分离得到的细胞具有较高的复苏率及细胞活性,对于下游应用影响较小,在保持细胞活性方面优于流式分选。磁性分选因其高灵敏度、高纯度、易操作、对目的细胞刺激较小等特性成为了细胞分选的方法,具有潜在的应用前景。
2 相关产品
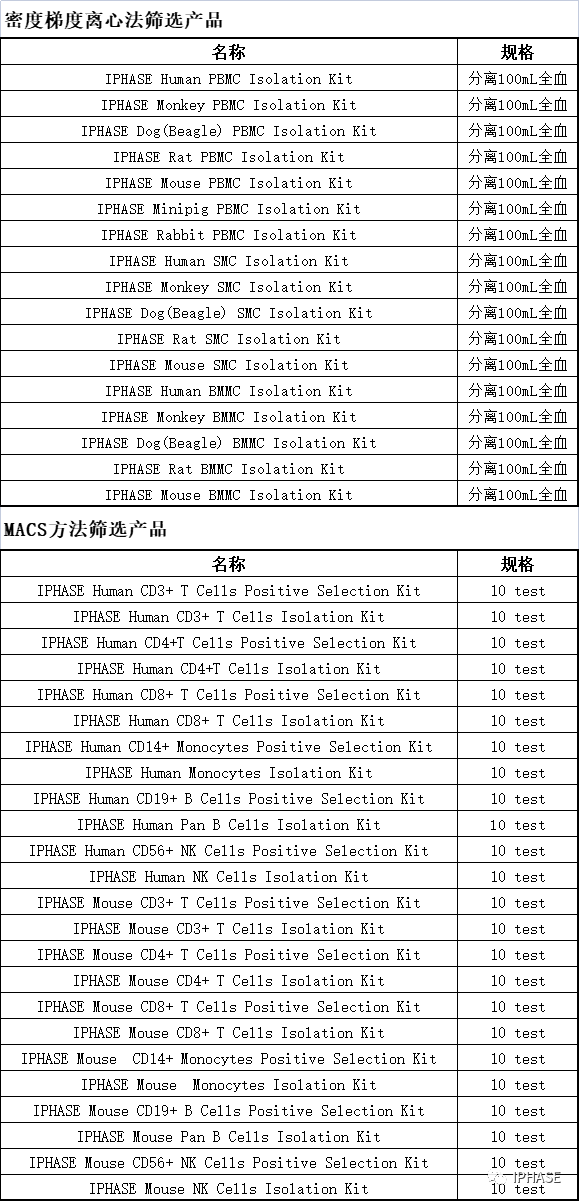
IPHASE/汇智和源凭借多年的研发经验,推出了多领域、多种类的高端科研试剂,为药物早期研发提供筛选工具,为生命科学领域的探索提供新材料、新方法和新手段,为食品、药品、化学品等的遗传毒性研究提供便捷产品,望广大科研工作者来电咨询,咨询热线400-127-6686。